1. Zastosowanie
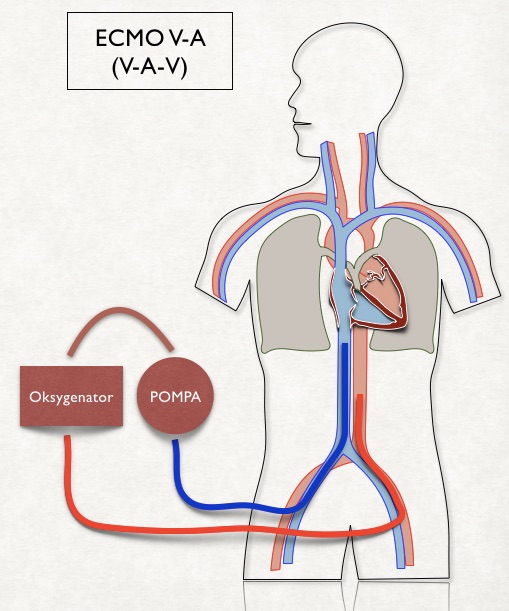
Użycie systemu ECMO w układzie żylno-tętniczym może całkowicie zastąpić funkcję serca i płuc. W tym przypadku układ pozaustrojowy podłączony jest do układu krążenia tak jak podczas zabiegów kardiochirurgicznych. Krew z układu żylnego po oksygenacji trafia bezpośrednio do układu tętniczego.
Impelmentacja ECMO V-A odbywa się najczęściej w nagłych okolicznościach. Wymaga pozostawania w gotowości zespołu dysponującego odpowiednim sprzętem i umiejętnościami.
Prowadzenie terapii w układzie V-A jest bardzo wymagające. Przepływy krwi są większe, zaburzenia pracy ECMO lub niedostosowanie parametrów objawiają się natychmiastową destabilizacją chorego. W zależności od sposobu kaniulacji dochodzić może do różnych powikłań związanych z metodą. Konieczny jest nieustanny nadzór nad sytemem pozaustrojowym i ciągła ocena funkcji serca i płuc.
Zastąpienie funkcji układu krążenia wymaga starannego rozważenia potencjalnych szans na przywrócenie skutecznej pracy mięśnia sercowego, bo tylko w takiej sytuacji zastosowanie układu pozaustrojowego będzie miało znamiona leczenia a nie tylko terapii uporczywej.
Wskazania:
1.
Oporny wstrząs kardiogenny. Sytuacja, w której dochodzi do gwałtownej destabilizacji i zaburzeń pracy
serca. Ale tylko wówczas, kiedy jest jeszcze możliwe podjęcie działań prowadzących do przywrócenia funkcji
narządu. Np. poprzez wykonanie angioplastyki wieńcowej lub bezpośredniej rewaskularyzacji mięśnia sercowego.
Użycie układu ECMO jako pomost do wyleczenia możliwe jest tylko w przypadku szans na odwracalność procesu
chorobowego.
2. Niewydolność serca. W większości przypadków nie jest wskazaniem do ECMO.
W przypadku zaostrzenia się przewlekłej niewydolności serca, zapalenia mięśnia sercowego, przełomu nadciśnienia płucnego, obecności licznych chorób towarzyszących - należy pamiętać, że pozaustrojowy system ECLS przywróci prawidłową perfuzję narządową, ale pozwoli zastąpić pracę niewydolnego układu krążenia pacjenta jedynie na kilkanaście dni. Wobec braku szans na odwracalność procesu chorobowego trzeba liczyć się z brakiem szans na wyzdrowienie i odłączenie ECMO. Tylko dla niektórych pacjentów pozostanie możliwość wszczepienia innych, długoterminowych systemów mechanicznego wspomagania krążenia w nadziei na doczekanie transplantacji narządu. Mówimy wówczas o użyciu ECMO jako pomostu do transplantacji.
3. E-CPR. Coraz częściej w literaturze fachowej znaleźć można doniesienia o rozszerzonym postępowaniu resuscytacyjnym u pacjentów z nagłym zatrzymaniem krążenia, u których zabiegi ALS nie prowadzą do powrotu czynności serca. W wytycznych CPR z 2015 roku techniki pozaustrojowych zabiegów resuscytacyjnych znajdują zastosowanie jako terapia
ratunkowa w wyselekcjonowanej grupie pacjentów, u których standardowe działania ALS
są nieskuteczne. Czytamy tam, że "E-CPR należy rozważyć kiedy możliwe jest leczenie odwracalnej
przyczyny zatrzymania krążenia (np. zawał serca, zatorowość płucna, hipotermia, zatrucia).
Badania obserwacyjne wykazały zwiększenie przeżywalności, jeśli zastosowano pozaustrojową resuscytację u
chorych z odwracalną przyczyną zatrzymania krążenia, nieobciążonych innymi chorobami współistniejącymi,
u których zatrzymanie krążenia nastąpiło przy świadkach, szybko wdrożono RKO a ECLS wdrożono do 60 min od
utraty przytomności." Ze względu na konieczność szybkiego wdrożenia ECLS do postępowania, w warunkach
polskich takie postępowanie wymaga jeszcze wielu inwestycji w sprzęt, szkolenia i zwiększenia dostępności
do miejsc na oddziałach iT.
4. Zatorowość płucna. Powikłana niestabilnością krążenia, u pacjentów, u których nie ma przeciwwskazań do leczenia przeciwkrzepliwego.
5. Zatrucia. Zwłaszcza lekami kardiodepresyjnymi (beta-blokery; blokery kanałów wapniowych, niektóre leki p/depresyjne).
2. Kaniulacja
Kaniulację żylną do ECMO w układzie żylno-tętniczym wykonuje się taką samą kaniulą i z takiego samego dostępu jak przy podłączaniu na dwie kaniule układu żylno-żylnego. Różnica polega jedynie na umiejscowieniu końcówki kaniuli. W ECMO V-V zależy nam aby utlenowana krew napływająca przez żyłę główną górną nie była pobierana przez kaniulę żylną w żyle głównej dolnej, dlatego należy umieścić ją w pewnej odległości od przedsionka. W przypadku ECMO V-A końcówkę kaniuli żylnej pozycjonujemy w prawym przedsionku, aby zapewnić maksymalny spływ krwi żylnej z dorzecza obu żył głównych.
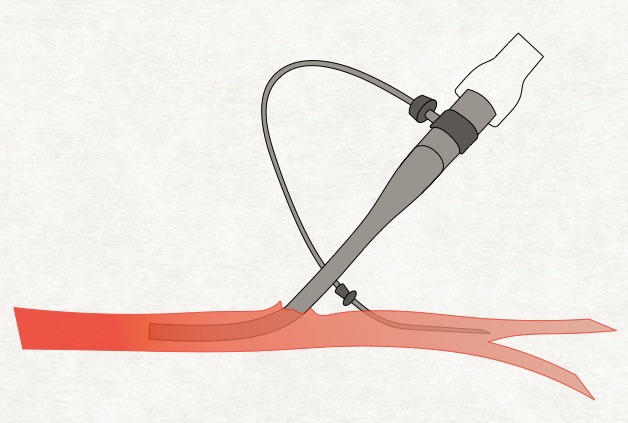
Duża trudność związana jest z kaniulacją tętniczą. Najszybszy dostęp prowadzi przez tętnicę udową i z tego powodu jest wykonywany najczęściej. Podłączanie ECMO w układzie V-A odbywa się bowiem najczęściej w trybie ratunkowym i czas gra najważniejszą rolę.
Z tą kaniulacją wiążą się dodatkowe problemy. Po pierwsze ostre niedokrwienie kończyny dolnej po stronie kaniulacji. Dla przywrócenia krążenia w kończynie dolnej konieczne jest wykonanie kolejnego nakłucia. Należy wprowadzić dodatkowy cewnik do tętnicy udowej powierzchownej w kierunku obwodowym i połączyć go z wprowadzoną kaniulą prowadzącą krew z ECMO. Tak powstałym sztucznym shuntem można wystarczająco zabezpieczyć perfuzję obwodową w kończynie.
W Klinice Kardiochirurgii i Transplantologii szpitala Przemienienia Pańskiego w Poznaniu do wytworzenia opisanego shuntu wykorzystujemy koszulki naczyniowe 5 lub 6F o długości 10-12 cm. Kaniulację naczynia wykonujemy przezskórnie pod kontrolą USG, a następnie przy pomocy Dopplera kontrolujemy przepływ w naczyniach obwodowo od miejsca kaniulacji. Shunt ten przez cały okres leczenia wymaga bardzo częstej kontroli i sprawdzania drożności.
Drugim problemem, jaki wiąże się z tętniczą kaniulacją udową jest
kierunek napływu krwi utlenowanej. Strumień krwi tętniczej wpływa do aorty w przeciwnym do
fizjologicznego kierunku. Zwiększa to opory następcze dla już i tak niewydolnego serca, utrudniając
opróżnianie się lewej komory. W zależności od stopnia wydolności płuc i serca może dochodzić do narastania
kolejnych powikłań związanych z niedotlenieniem górnej połowy ciała (zespół Harlekina - patrz pkt 3)
czy hydrostatycznym obrzękiem płuc (pkt 4).
Dlatego w niektórych sytuacjach można zmieniać miejsce
kaniulacji tętniczej na usytuowane w górnej połowie ciała. Najczęściej dotyczy to tętnicy podobojczykowej lub
szyjnej. Przy czym najbezpieczniejszą jest wówczas technika chirurgiczna polegająca na doszyciu do naczynia
protezy naczyniowej, do której następnie wprowadza się kaniulę tętniczą. Zabezpiecza to napływ krwi zarówno
w fizjologicznym kierunku do aorty jak i obwodowo do naczyń mózgowych lub kończyny górnej.
⇧
powrót
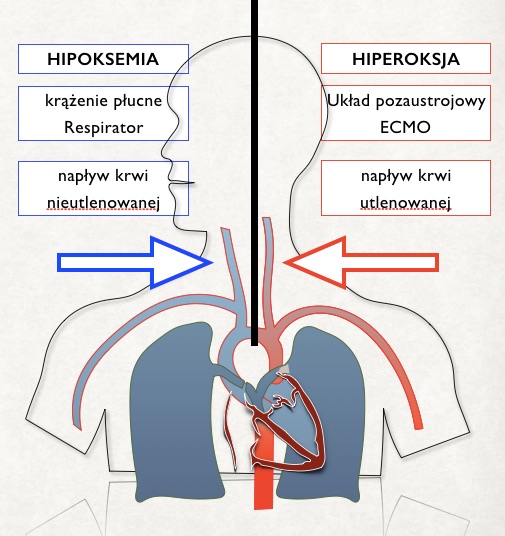
3. Syndrom Harlekina
W przypadku tętniczej kaniulacji udowej utlenowana krew z ECMO płynie w aorcie w kierunku dogłowowym. Często jest tak, że u leczonego pacjenta zachowana jest jeszcze resztkowa funkcja mięśnia sercowego. Wówczas lewa komora również dostarcza do aorty krew, która napływa do krążenia płucnego. Problem pojawia się, jeżeli płuca tego chorego są niewydolne lub w wyniku choroby doszło do masywnych zaburzeń wentylacji do perfuzji. Wówczas nawet mimo zaawansowanej wentylacji mechanicznej nie dochodzi do wystarczającej oksygenacji krwi żylnej w płucach.
Mamy wtedy do czynienia z niebezpieczną sytuacją, kiedy przez tętnicę
udową do aorty napływa wysoko utlenowana krew z ECMO a z lewej komory dostaje się do łuku aorty krew
nieutlenowana. Dochodzi wówczas do powstanie zespołu niedotlenienia górnej połowy ciała. Na lewej ręce
możemy mieć akceptowalny poziom wysycenia hemoglobiny tlenem, a na ręce prawej już nie. Sytuacja taka
grozi ciężkim niedotlenieniem CUN mimo prawidłowo działającego układu pozaustrojowego.
Sposoby na rozwiązanie tego problemu są dwa. Po pierwsze zmiana kaniulacji tętniczej na dostęp z górnej połowy ciała (tętnica szyjna lub podobojczykowa). Drugim sposobem jest rozbudowa pozaustrojowego układu ECMO o dodatkowe ramię żylne. Należy rozdzielić linię tętniczą rozgałęźnikiem na dwie. Jedna z nich nadal podawać będzie krew do tętnicy udowej. Dla drugiej wprowadzić należy kolejną kaniulę do żyły głównej górnej (jak w ECMO V-V) i przez nią skierować dodatkowy napływ krwi utlenowanej. Powstanie wówczas hybrydowe podłączenie ECMO V-A-V. W takiej sytuacji nawet jeśli dochodzi do przecieku krwi przez płuca to jest ona też utlenowana bo napływa z układu pozaustrojowego. ⇧ powrót
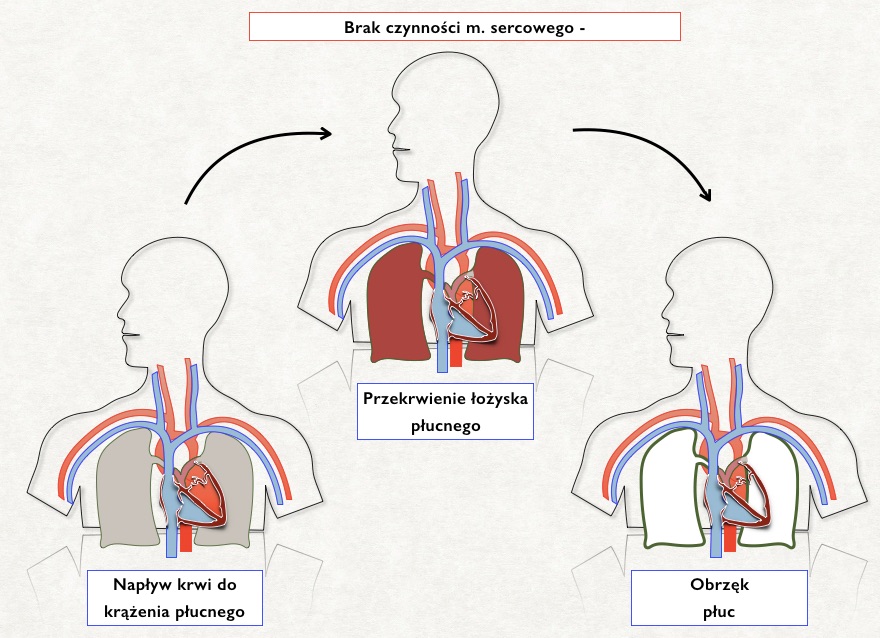
4. Obrzęk płuc
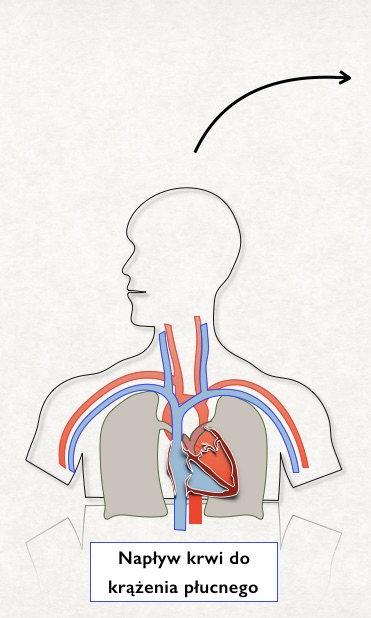
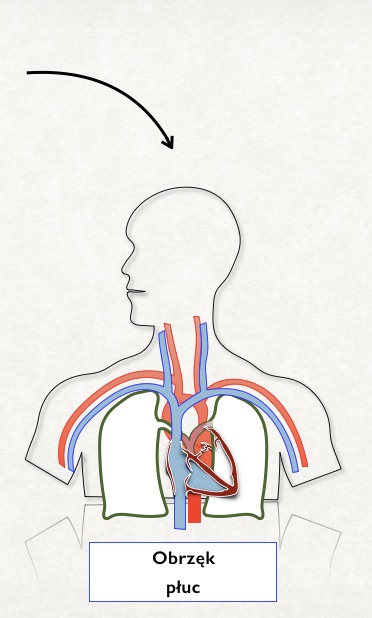
W każdym ze sposobów kaniulacji żylno-tętniczej spływ krwi do aparatu realizowany jest przez kaniule, której koniec sięgać powinien w okolice prawego przedsionka. Nawet przy prawidłowym umiejscowieniu kaniul żylnych i przy wydajnej pracy pompy generującej bardzo duży przepływ, jakaś cześć krwi z dorzecza żylnego przedostanie się do prawej komory i dalej do krążenia płucnego. Jeżeli mięsień sercowy w trakcie wspomagania zachowuje resztkową czynność skurczową i można w obrazowaniu ECHO dojrzeć otwierającą się zastawkę aortalną, to krew ta ma szansę żyłami płucnymi, fizjologiczną droga powrócić do krążenia. Jeżeli jednak czynność serca jest całkowicie niewydolna, dojdzie do gromadzenia się krwi w łożysku płucnym bez możliwości odpływu. Obserwować będziemy wtedy bardzo szybko narastający w mechanizmie hydrostatycznym obrzęk płuc, który w dłuższej perspektywie doprowadzić moze do zmian przewlekłych. I w konsekwencji, jeżeli nawet czynność serca powróci do funkcji pozwalającej odłączyć wspomaganie pozaustrojowe, to chory nie bedzie w stanie skutecznie uruchomić wymiany gazowej w uszkodzonych płucach. Stad często po zakończonej sukcesem terapii ECMO V-A chorzy wymagaja konwersji na ECMO V-V.
W takiej sytuacji konieczne jest dbanie o to aby mięsień sercowy zachował jakąś resztkową czynność skurczową. Stąd odstawianie katecholamin w trakcie wspomagania powinno być bardzo ostrożne i wykonywane pod kontrolą echokardiografii.
Przy najpopularniejszej kaniulacji tętniczej z dostępu udowego należy pamiętać, że strumień krwi prowadzony jest w aorcie w odwrotnym kierunku do fizjologicznego. Taki wsteczny napływ krwi w tętnicy głównej zwiększa dodatkowo opory dla i tak niewydolnej lewej komory i utrudnia jej opróżnianie się. Jednym ze sposobów na złagodzenie tego mechanizmu jest jednoczesne zastosowanie kontrpulsacji aortalnej. Zapadajac sie w czasie skurczu komory, balon aortalny zmniejsza te opory i ułatwia otwarcie się zastawki aortalnej.
Przy narastaniu obrzęku płuc najlepszym sposobem jest mechaniczne zwentowanie łożyska płucnego poprzez założenie drenu odsysającej krew do lewego przedsionka. Jest to już postępowanie bardzo inwazyjne. Można dokonać tego przezskórnie, endowaskularnie, przebijając się cewnikiem przez przegrodę miedzyprzedsionkową, albo chirurgicznie z dostępu przez torakotomię.